Die Brennstoffzelle: Eine moderne Erfindung?
Kurzinfo Brennstoffzelle
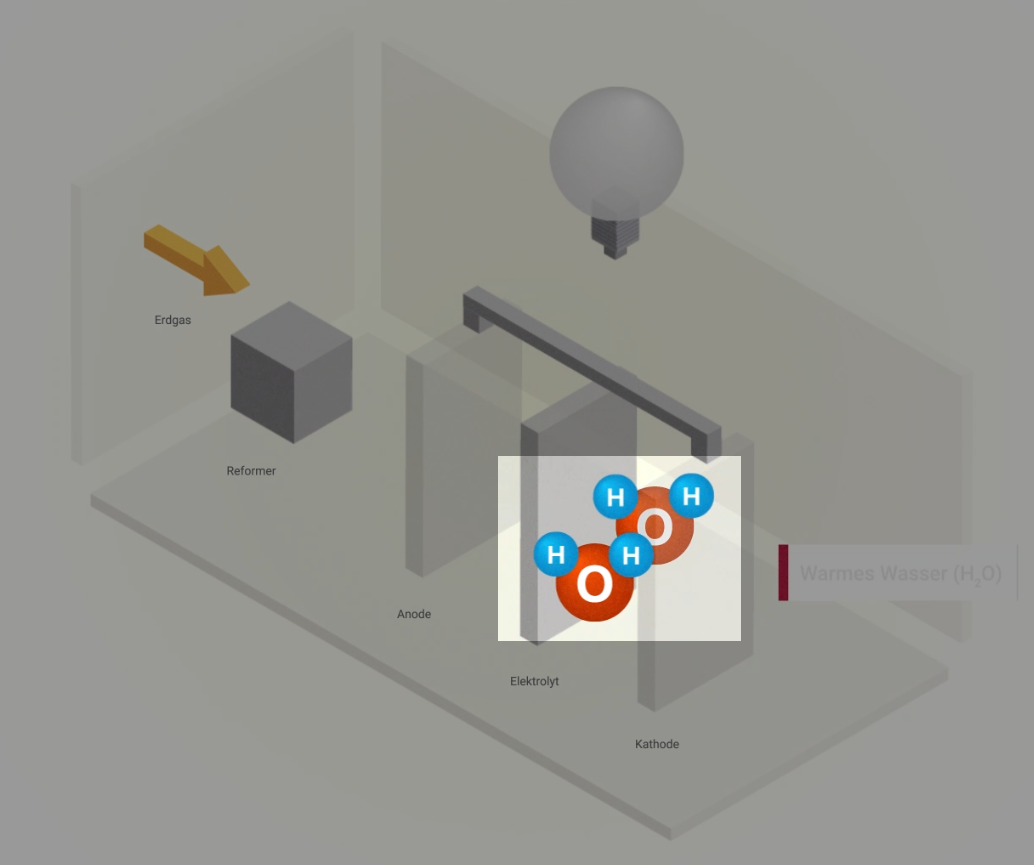
In einer Brennstoffzelle reagiert Wasserstoff mit Sauerstoff. Dabei entstehen Strom, Wärme und Wasser.

Jules Verne
1875 schrieb der Science-Fiction-Autor Jules Verne in seinem Buch Die geheimnisvolle Insel:
„Das Wasser ist die Kohle der Zukunft. Die Energie von morgen ist Wasser, das durch elektrischen Strom zerlegt worden ist. Die so zerlegten Elemente des Wassers, Wasserstoff und Sauerstoff, werden auf unabsehbare Zeit hinaus die Energieversorgung der Erde sichern.“
Diese Beschreibung der Wasserstoff-Elektrolyse als eine Grundlage für die Nutzung der Brennstoffzelle in der Zukunft ist erstaunlich modern. Jules Verne hatte aber nicht einfach nur gut geraten, denn die wissenschaftlichen Grundlagen zur Nutzung von Wasser über den Umweg von Wasserstoff als Energiequelle waren bereits gelegt.
Meilensteine der Brennstoffzelle

Christian Friedrich Schönbein
1838
Der deutsch-schweizerische Chemiker Christian Friedrich Schönbein entdeckte das grundlegende Prinzip der Brennstoffzelle: bei einem Versuch ließ er im Jahr 1838 Platindrähte in einer Elektrolytlösung mit Wasserstoff und Sauerstoff umspülen. Zwischen diesen Drähten konnte er Spannung messen und stellte so fest, dass elektrischer Strom erzeugt wurde.

William Robert Grove
1839
Der walisische Chemiker Sir William Robert Grove las Schönbeins Veröffentlichung, forschte weiter und entwickelte schließlich die Variante einer galvanischen Zelle, in der das Brennstoffzellenprinzip zur stetigen Energieerzeugung angewendet werden kann. Zu seinen Lebzeiten fand sie jedoch wenig Beachtung.
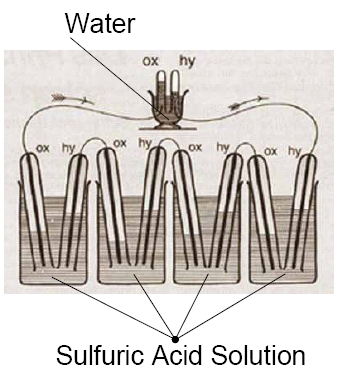
Erste Funktionsfähige Brennstoffzelle, 1842

Durch die Explosion eines Sauerstofftanks musste die Apollo 13-Mission abgebrochen werden: An Bord konnte nur noch für wenige Stunden Energie produziert werden. Foto: Das beschädigte Servicemodul der Apollo 13 nach der Abtrennung
1960er
Zurück ins Licht der breiten Öffentlichkeit brachte es die Technik in den 1960er-Jahren: Die NASA setzte auf Brennstoffzellen, um an Bord von Raumfähren Energie zu erzeugen und Trink- und Kühlwasser herzustellen. Alles, was es dazu brauchte, waren Wasserstoff- und Sauerstofftanks sowie eine Brennstoffzelle, in der die Reaktion stattfand.
Arbeitsauftrag 1
- Stelle Vermutungen an, warum die Brennstoffzelle nach ihrer Erfindung über ein Jahrhundert lang kaum genutzt wurde. Tipp
Die Brennstoffzelle konnte sich lange nicht durchsetzen, weil die technischen Möglichkeiten nicht ausgereift genug waren. Weder war Wasserstoff in ausreichender Menge herstellbar, noch standen die Möglichkeit zur Verfügung, Wasserstoff sicher über weite Strecke zu transportieren. Außerdem gab es ausreichend andere Energiequellen (z.B. Kohle und Erdöl), die leichter zur Energiegewinnung genutzt werden konnten und von deren negativen Auswirkungen auf die Erderwärmung man noch nichts wusste.
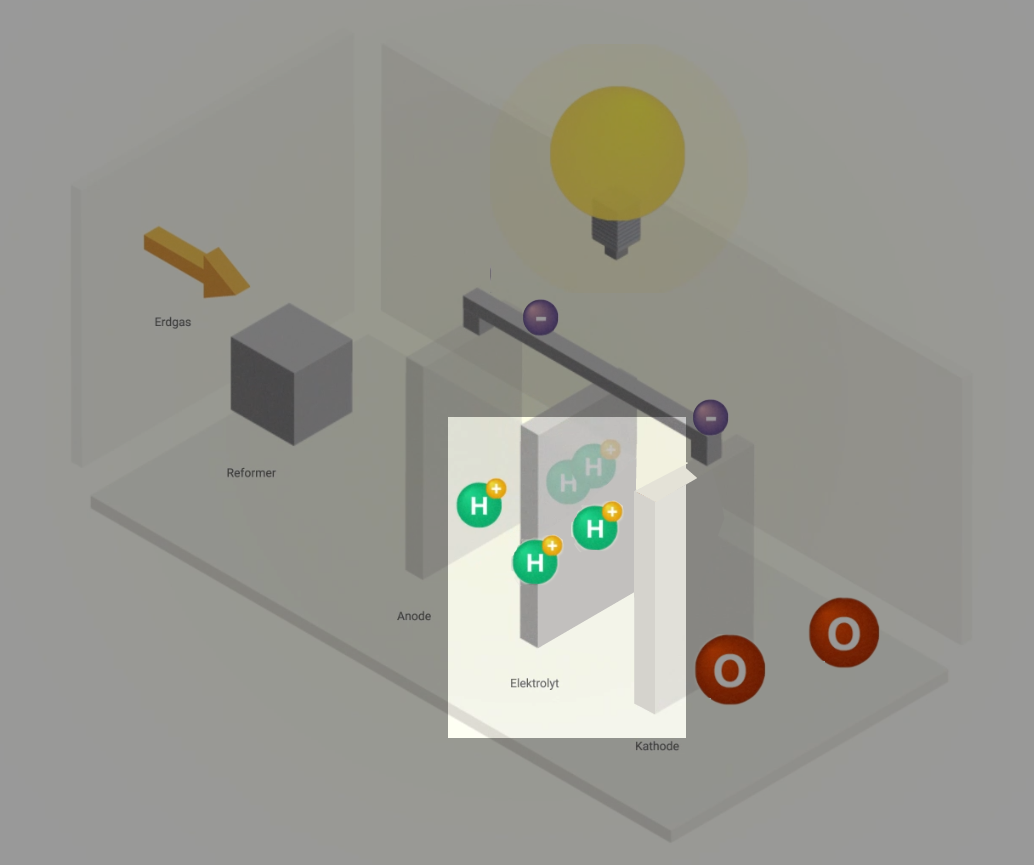
Wie funktioniert die moderne Brennstoffzelle?
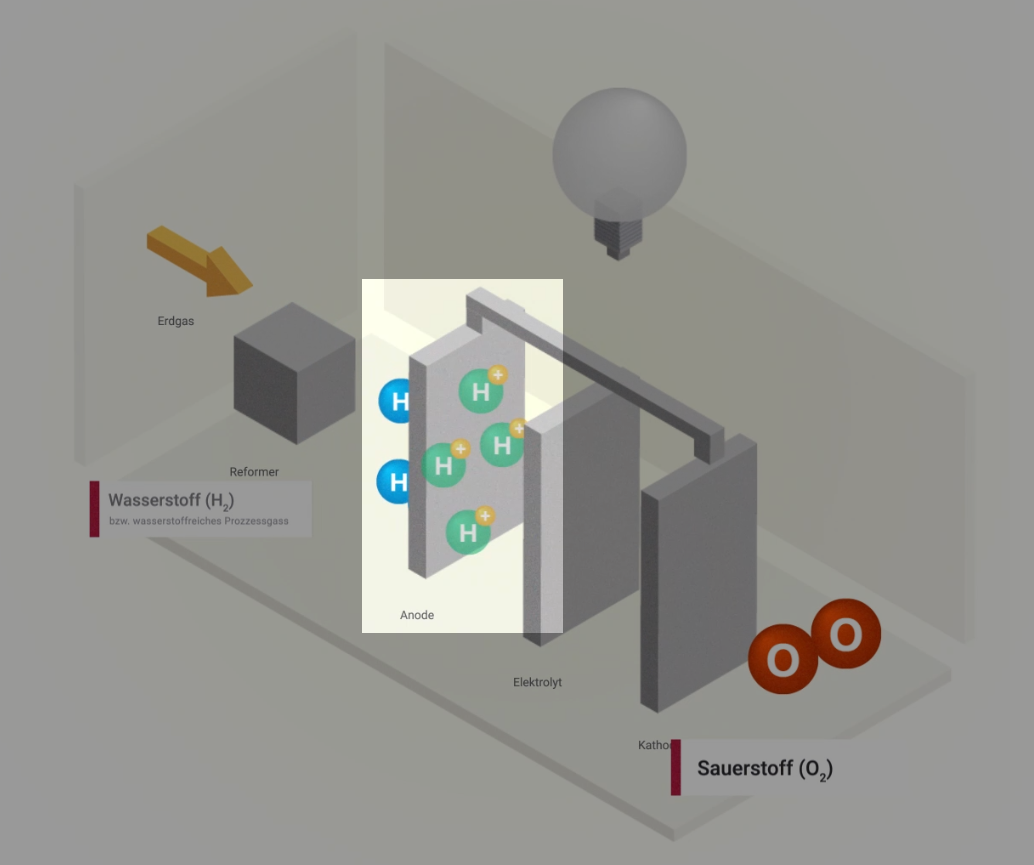
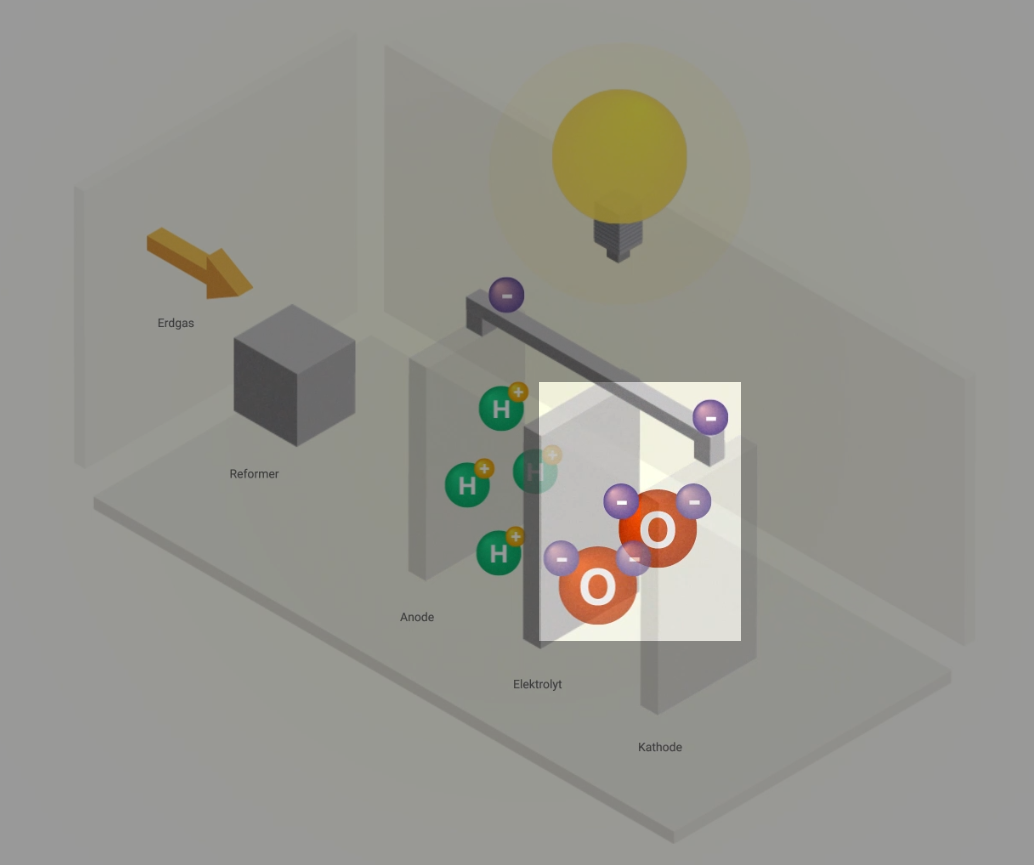
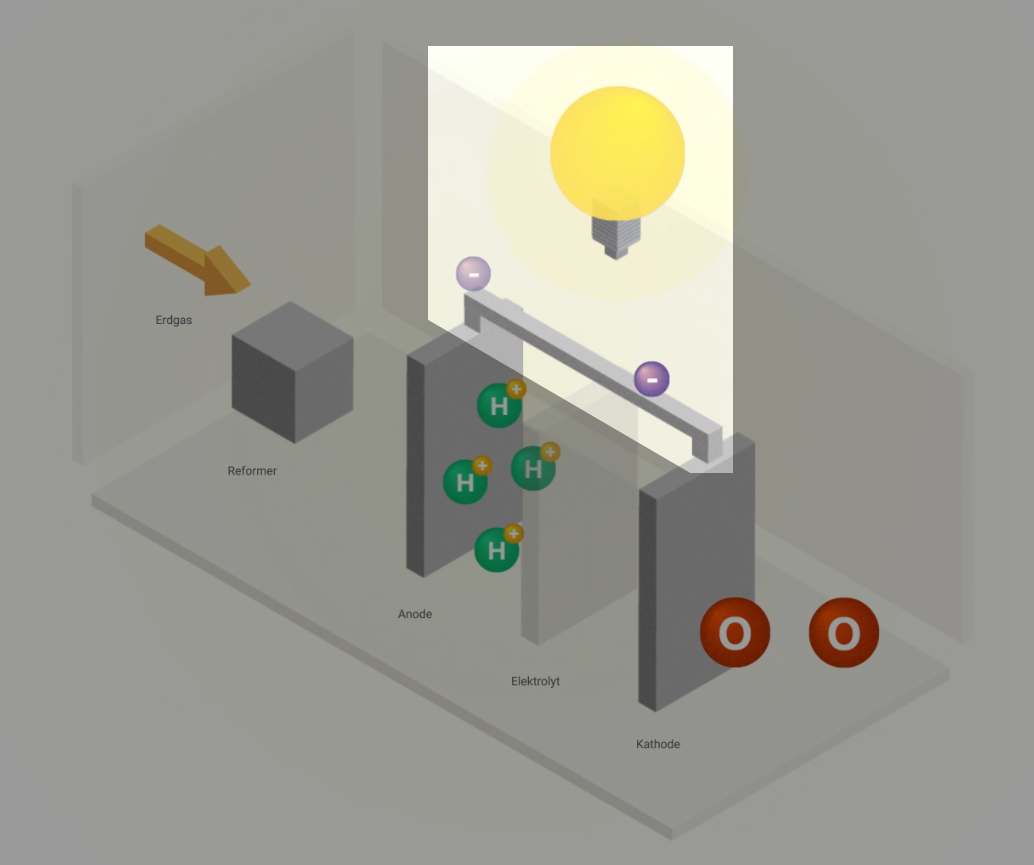
Funktionsprinzip
Brennstoffzellen nutzen ein sehr einfaches Prinzip: die Elektrolyse – nur auf umgekehrte Weise. Denn Wasserstoff hat die natürliche Eigenschaft, von sich aus zusammen mit Sauerstoff wieder zu Wasser reagieren zu wollen. Unter kontrollierten Bedingungen kommt es ohne externe Energiezufuhr zu einer kontrollierten „Knallgasreaktion“. Dieser Vorgang wird als kalte Verbrennung bezeichnet. Hierbei entstehen elektrische Energie und Wärme.
Aufbau
Eine Brennstoffzelle besteht aus zwei Elektroden – der Anode (Minuspol) und der Kathode (Pluspol). Sie sind durch den Elektrolyt mit einer festen, ionen-durchlässigen Membran getrennt. Die beiden Elektroden sind mit einem Katalysator beschichtet, z. B. Nickel oder Platin.
Arbeitsauftrag 2
- Bringe die Textbausteine zum Ablauf der Reaktionen, die in einer Brennstoffzelle stattfinden, durch Ziehen in eine sinnvolle Reihenfolge.
- Ordne jedem Reaktionsschritt das passende Bild zu.
- Ordne abschließend die beiden Strukturformeln dem jeweils passenden Reaktionsschritt zu.
Arbeitsfläche
| Reaktionschritte | Grafisches Schema | Strukturformel |
|---|---|---|
|
|
|
Wie wird die Brennstoffzelle heute und in Zukunft eingesetzt?
Seit den Anfängen der Brennstoffzelle hat sich viel getan. Das Potential der Brennstoffzelle ist längst erkannt, sodass die Technik immer mehr Einsatzformen findet.

Produktion von Brennstoffzellen-Stacks (in Reihe geschaltete Stapel von Brennstoffzellen), Foto: BDEW/Swen Gottschall
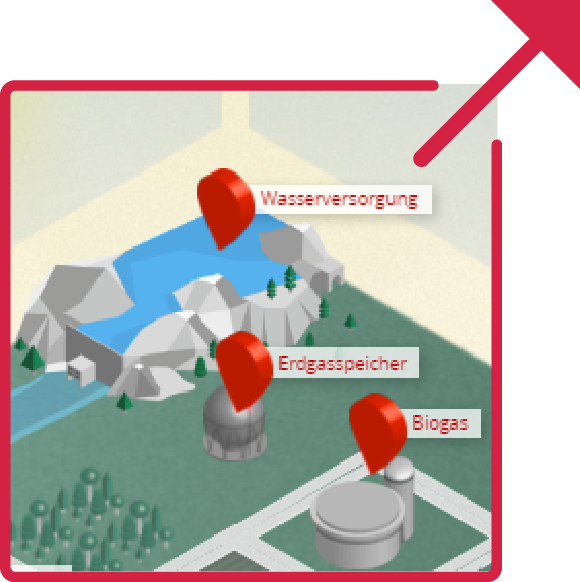
Arbeitsauftrag 4
- Die untenstehende interaktive Karte zeigt dir, wie Energie in einer Stadt gewonnen und genutzt werden kann. Schau dich auf der Stadtkarte um und informiere dich über die Einsatzmöglichkeit von Brennstoffzellen in Gas-Brennstoffzellen-Heizungen.
- In manchen Städten sind bereits Brennstoffzellenbusse im Einsatz. Brennstoffzellenbusse (auch
Wasserstoffbusse genannt) sind Fahrzeuge mit Elektroantrieb, bei denen durch eine Brennstoffzelle
elektrische
Energie aus Wasserstoff erzeugt wird.
Recherchiere: Wo werden Brennstoffzellenbusse eingesetzt?
Nenne einige Anwendungsbeispiele.
Was spricht für den Einsatz, was dagegen? Fülle die Felder des Steckbriefs aus und stelle deiner Lerngruppe deine Ergebnisse vor.
Tipp

Wasserstoffbusse für Münster © Stadtwerke Münster GmbH
| Brennstoffzellenbusse | |
|---|---|
| Einsatzorte | |
| Gründe für den Brennstoffzelleneinsatz: | |
| Gründe gegen den Brennstoffzelleneinsatz: | |